Top
김영주 기자
의학신문, 2022.07.18
['희귀의약품 시장 현황 및 전망 보고서' 보기 - 클릭]
l 희귀약, 일반 신약 비해 R&D비용 절반에 성공확률 3배 ‘매출도 높아’
l 올해 5월 기준 전 세계 신약 파이프라인의 79%가 희귀질환 신약
반면 국내 희귀질환 지정 제품도 적고, 정부 지원도 약해
희귀의약품 개발이 글로벌 의약품 신약개발의 대세가 되고 있다. 일반 신약개발에 비해 R&D 비용은 적고 성공확률은 높으며, 매출은 많아 빅 파마들이 관심을 쏟고 있고, 각국 정부는 독점기간 확보를 비롯, 각종 세제혜택 등 지원을 집중하며 희귀의약품 개발을 독려하고 있다. 반면 우리나라의 경우 아직까지 파이프라인도 적고 정부지원도 약하다. 한국혁신의약품컨소시엄(KIMCo)은 최근 ‘희귀의약품(Orphan drug) 시장 현황 및 전망’을 통해 글로벌 추세 및 국내 현황을 짚었다.
희귀의약품 ‘low risk, high return’, 신약개발의 대세 부각
2019년 보고된 문헌에 따르면 희귀의약품의 임상1상부터 허가승인까지의 성공률은 17.0%로 비 희귀의약품(5.9%)에 비해 약 3배 높은 것으로 나타났고, 임상개발 평균 소요비용은 2억4200만 달러로 비 희귀의약품 4억8900만 달러의 약 절반가량으로 나타났다. 이는 제약회사 입장에서 희귀질환 적응증으로 신약 개발 시 비용 절감 및 높은 성공확률로 프로젝트 리스크를 줄일 수 있다는 것을 의미한다.
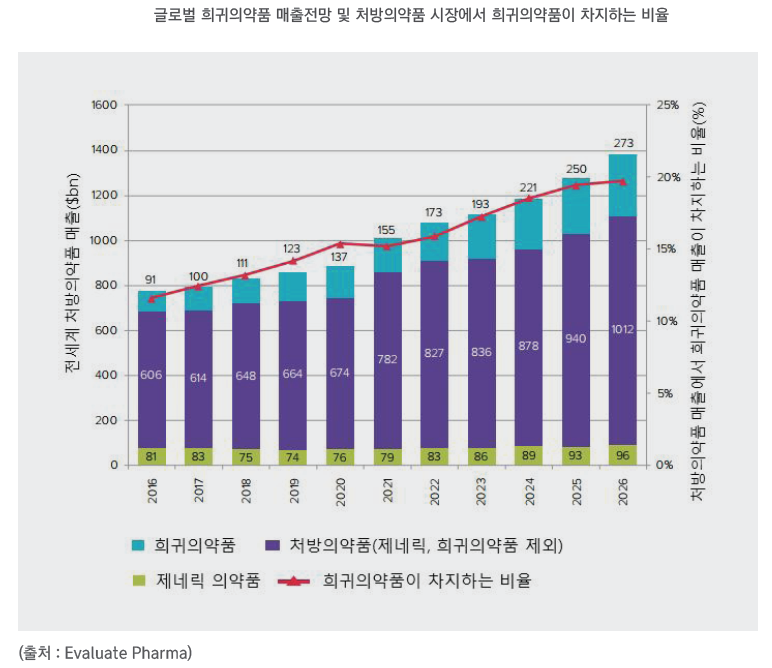
희귀의약품은 환자 수가 적어 의약품 매출이 크지 않을 것으로 생각하면 큰 오산이다. 제약회사들은 희귀의약품 지정(Orphan Drug Designation, ODD)과 신속 심사 프로그램을 통해 임상 2상 이후 시장에 진입한 뒤 비희귀질환 적응증을 지속적으로 확대하는 전략으로 의약품 매출을 극대화를 꾀한다. 실제로 애브비의 ‘휴미라’와 존슨앤존슨의 ‘레미케이드’ 매출의 90%이상은 비희귀질환 환자들로부터 발생하며, 로슈의 항암제 ‘아바스틴’은 ODD지정 이후 지속적으로 적응증을 추가해 매출을 두 배 가까이 끌어 올렸다.
2022년 5월 기준 희귀의약품 파이프라인은 전 세계 신약(New Molecular Entity) 파이프라인의 79%를 차지하고 있다. 후기 임상 개발 단계 기준 항암제 파이프라인이 가장 많고(6112개, 59%), 내분비, 혈액 및 면역 분야(833개, 8%), 정신 질환 분야(759개, 7%) 파이프라인이 그 다음으로 많이 개발되고 있다. 임상 단계별로는 임상 1상 3142개(30%), 임상 2상 5646개(55%), 임상 3상 1296개(13%)로 임상 2상에 머물러 있는 파이프라인이 절반이상으로 나타났다.
제약선진국, 희귀의약품 기준은 달라도 독점 및 지원 혜택엔 ‘진심’
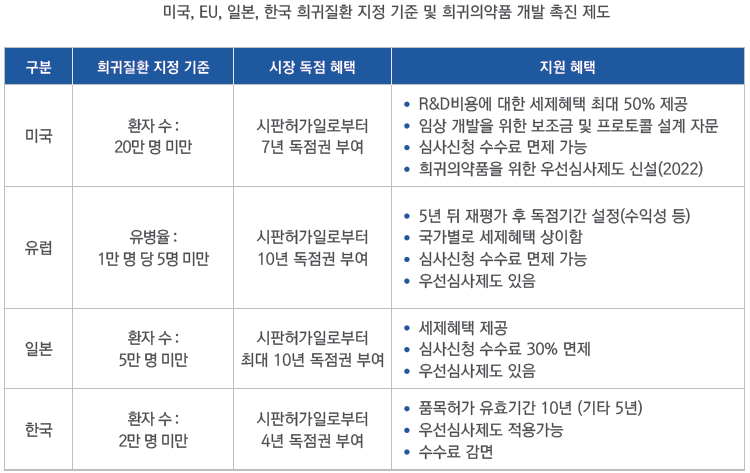
미국FDA에 따르면 미국 내 3000만 명 이상 인구가 7000개 이상의 희귀질환으로 고통 받고 있으며, 세계제약협회연맹(IFPMA)은 전 세계 약 4억 명의 환자들이 희귀질환을 앓고 있는 것으로 추정하고 있다.
희귀질환을 정의하는 기준은 국가별로 다르다. 미국이 환자수 20만 명 미만을, 유럽은 유병율 1만명 당 5명 미만인 경우를 희귀질환으로 정의한다. 이 같이 질환 정의는 다르나 희귀의약품 개발을 촉진시키기 위한 여러 인센티브를 제도적으로 보장하고 있다는 점은 공통적 이다. 희귀의약품에 대한 개발 촉진 제도는 1983년 미국이 희귀의약품법(The Orphan Drug Act)을 제정하면서 시작됐고, 규제기관이 개발단계에서부터 희귀의약품으로 지정해 개발 단계에서 보조금 및 세제 혜택을 지원하고, 시판 후 시장 독점권을 부여하는 방식이다. 여기서 독점권이란 동일 질환의 치료목적으로 동일 또는 유사의약품의 허가를 금지하는 것이다. 미국 FDA 기준 일반 신약(New Chemical Entity)이 독점권을 5년까지 부여받게 되는데 희귀의약품 지정(ODD)을 받게 되면 독점권을 7년까지 부여받을 수 있게 된다. 특히, ODD는 반드시 의약품 허가 우선심사제도의 대상이 되는 것이 아니었으나, 희귀의약품을 위한 우선심사제도가 신설됐다. 우리나라는 2016년 12월 30일부터 희귀질환관리법을 시행, 희귀의약품 인센티브에 대한 법적근거를 마련했다.
한미·SK바이오팜 등 희귀약 개발 나서, 파이프라인·제도적 지원 미진
국내 희귀의약품 개발은 주로 바이오벤처에 의해 주도되고 있으며, 최근 한미, SK바이오팜 등 제약회사들도 희귀의약품 개발에 뛰어드는 추세이다 국내 기업이 개발하고 있는 희귀의약품 파이프라인은 2019년 기준 106개가 있는 것으로 파악되며 최근 10년간 (’12년~’22년 5월) 미 FDA ODD지정을 받은 파이프라인은 총 63개로 나타났다.
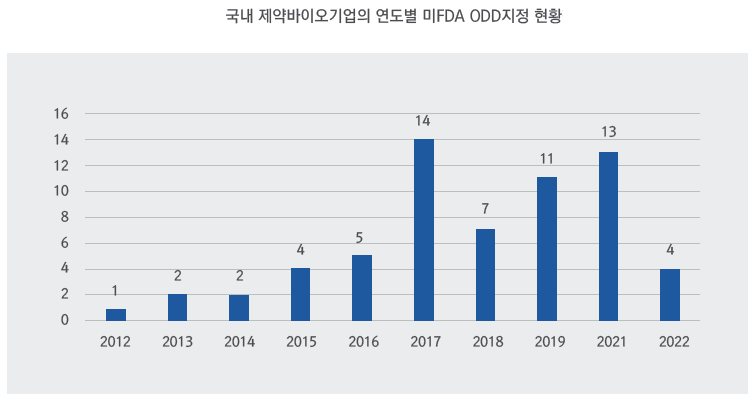
글로벌 트렌드와 비교해보면, 마찬가지로 항암 분야와 바이오의약품의 비중이 높은 것으로 나타났지만, 국내 희귀의약품은 주로 임상1상에 머물러 있다는 특징을 발견할 수 있다. 국내 희귀질환자 수는 매년 증가하고 있는 반면, 희귀의약품으로 지정된 제품의 수가 미국, 일본, 유럽에 비해 적을 뿐만 아니라 제도적 지원이 빈약한 실정이다. 희귀의약품에 집중하고 있는 다국적 제약회사들처럼 희귀의약품 시장 트렌드를 이해하고 희귀의약품 개발 역량을 강화하는 전략은 글로벌 신약 개발에 도전하는 국내 제약사 및 바이오벤처가 필수로 고려해봐야 할 것이다.